Tijdens de Covid-pandemie heeft de Amerikaanse regering miljarden dollars uitgegeven aan bijna 400 producten die bedoeld zijn om honderden miljoenen mensen te beschermen, diagnosticeren en behandelen – allemaal met het label ‘EUA’ of ‘Emergency Use Authorization’.
Maar wat betekent EUA eigenlijk?
Zelfs voordat we die vraag beantwoorden, en om te begrijpen waar de EUA staat in relatie tot andere trajecten voor het autoriseren of goedkeuren van medische producten, is het nuttig om te kijken naar wat EUA niet is:
EUA is geen aanduiding voor een experimenteel product dat een klinische proef ondergaat
Als we maar één ding over EUA begrijpen, zou het dit moeten zijn: EUA is niet van toepassing op een product dat een klinische proef ondergaat die valt onder de FDA-regelgeving of andere wettelijke vereisten.
EUA is ook niet hetzelfde als Expanded Access Use (EAU), vaak ‘compassionate use’-toegang genoemd, wat van toepassing is op het verlenen van toegang aan patiënten met ernstige, ongeneeslijke ziekten tot experimentele producten voordat deze volledig zijn goedgekeurd.
Deze tafel van een FDA-CDC 2020-presentatie vat de verschillen samen tussen producten die klinische proeven ondergaan, producten die aan patiënten worden gegeven via uitgebreide “compassionate” toegang, en producten die zijn geautoriseerd via EUA:
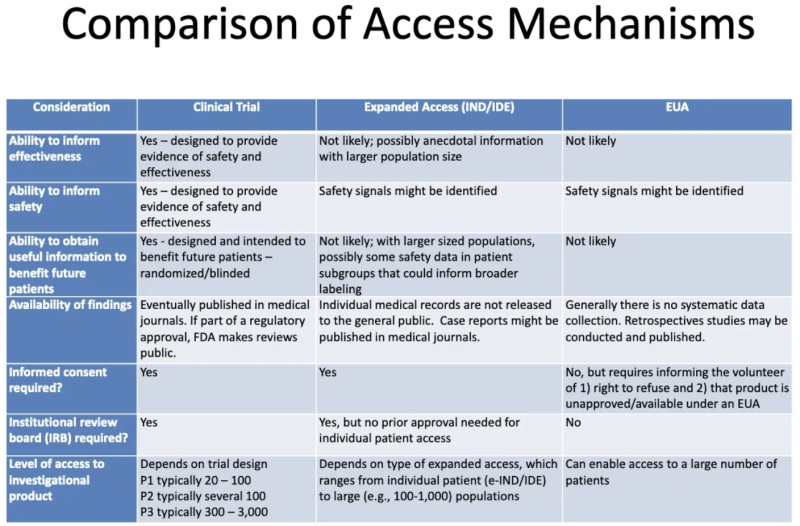
Dit is wat deze tabel ons vertelt over EUA:
- Het is niet waarschijnlijk dat het proces voor het verlenen van EUA enige informatie zal opleveren over de effectiviteit van een product.
- Het proces voor het verlenen van EUA is niet bedoeld om bewijs te leveren van de veiligheid of effectiviteit, maar er kunnen wel veiligheidssignalen worden geïdentificeerd.
- Het is onwaarschijnlijk dat, zodra een product EUA wordt toegekend en aan sommige patiënten wordt toegediend, er enige nuttige informatie zal worden verkregen ten behoeve van toekomstige patiënten.
- Er vindt geen systematische gegevensverzameling plaats over de effectiviteit of veiligheid van EUA, en er worden geen gegevens gepubliceerd in medische tijdschriften als onderdeel van het goedkeuringsproces van de regelgevende instanties.
- Er is geen geïnformeerde toestemming vereist, maar patiënten die “vrijwillig” het product innemen, moeten te horen krijgen dat ze kunnen weigeren en dat het product niet is goedgekeurd/beschikbaar onder de EUA.
- Er is geen institutionele beoordelingsraad (IRB) vereist. [IRB is een bestuur dat het welzijn van proefpersonen in klinische onderzoeken moet beschermen]
Om nog verder te verduidelijken hoe gescheiden de EUA is van elk normaal goedkeuringsproces, in a 2009 publicatie van het Institute of Medicine van de National Academies, vinden we deze verklaring:
Het is belangrijk om te erkennen dat een EUA geen deel uitmaakt van het ontwikkelingstraject; het is een volledig afzonderlijke entiteit die alleen tijdens noodsituaties wordt gebruikt en geen deel uitmaakt van het goedkeuringsproces voor geneesmiddelen. (pag. 28)
Om samen te vatten:
Het is onwaarschijnlijk dat het proces voor het verlenen van EUA aan een product enig bewijs van veiligheid of effectiviteit zal opleveren. Zodra aan een product EUA wordt toegekend en aan patiënten wordt toegediend, is het onwaarschijnlijk dat er enige nuttige informatie zal worden verkregen ten behoeve van toekomstige patiënten, omdat er geen systematische gegevensverzameling plaatsvindt over de effectiviteit of veiligheid.
Op basis van al deze zeer duidelijke informatie van de CDC/FDA en de IMNA zou het eerlijk zijn om te concluderen dat autorisatie voor gebruik in noodgevallen een proces is dat zeer oordeelkundig moet worden toegepast en alleen in gevallen van ernstige noodsituaties.
Laten we nu eens kijken naar welke soorten noodsituaties de EUA juridisch moet aanpakken.
EAU is bedoeld voor noodsituaties met massavernietigingswapens
De wetten die het hierboven beschreven EUA “Toegangsmechanisme” toestaan, zijn opgesteld voor gevallen van extreme, onmiddellijke noodsituaties waarbij massavernietigingswapens (WMD) betrokken zijn, ook wel CBRN-agentia (chemische, biologische, radiologische, nucleaire) middelen genoemd.
Dit is hoe de Food & Drug Administration dat doet (FDA) beschrijft haar EUA-bevoegdheden:
Sectie 564 van de FD&C-wet (21 USC 360bbb–3) stelt de FDA in staat de bescherming van de volksgezondheid tegen biologische, chemische, nucleaire en radiologische agentia te versterken.
Met deze autoriteit van de EUA kan de FDA ervoor zorgen dat in noodsituaties medische tegenmaatregelen kunnen worden genomen om ernstige of levensbedreigende ziekten of aandoeningen veroorzaakt door biologische, chemische, nucleaire of radiologische middelen te diagnosticeren, behandelen of voorkomen, wanneer er geen adequate, goedgekeurde en beschikbare alternatieven (naast andere criteria).
Deze EUA-bevoegdheden werden in 2004 verleend onder zeer specifieke omstandigheden die verband hielden met de paraatheid voor aanvallen door CBRN-agenten.
Zoals uitgelegd in de Bill of Health van Harvard Law,
Uiteindelijk was het de War on Terror die aanleiding zou geven tot toestemming voor gebruik in noodgevallen. Na de gebeurtenissen van 11 september 2001 en de daaropvolgende miltvuurmailaanvallen heeft het Congres de Project Bioshield-wet van 2004.
De record geeft aan dat het Congres zich specifiek richtte op de dreiging van bioterreur, en niet op de voorbereiding op een natuurlijk voorkomende pandemie.
Gegeven zo’n beperkte soort werkelijk extreme noodsituatie waarbij sprake is van een massavernietigingswapenaanval, is het begrijpelijk waarom het ‘toegangsmechanisme’ van de EUA niet veel regelgevend toezicht of naleving van productie- of klinische proefnormen vereist.
Dus wat vereist het EUA-toegangsmechanisme eigenlijk?
De 3 stappen voor autorisatie voor gebruik in noodgevallen (EUA)
Er moeten drie dingen gebeuren voordat EUA aan een medisch product kan worden toegekend:
- De minister van Binnenlandse Veiligheid, de minister van Defensie of de minister van Volksgezondheid en Human Services moeten vaststellen dat er sprake is van een noodsituatie waarbij sprake is van een aanval of de dreiging van een aanval met een CBRN-agent of van een ziekte die door een dergelijke agent wordt veroorzaakt.
- De FDA moet ervoor zorgen dat zij aan vier “wettelijke criteria” voldoet wanneer zij de EUA uitgeeft.
- De FDA moet “bepaalde vereiste voorwaarden opleggen” in de EUA.
EUA Stap 1: Het afkondigen van een CBRN-noodsituatie
De noodverklaring voor EUA staat los van en staat los van andere noodverklaringen die kunnen worden afgegeven door de president, de HHS-secretaris of iemand anders. Het moet specifiek worden afgegeven met het doel de EUA te activeren en kan onafhankelijk van enige andere noodverklaring worden beëindigd of verlengd.
Dit is wat zo stelt de EUA-wet zijn de vier mogelijke scenario’s voor het activeren van het EUA “toegangsmechanisme”:
- een vaststelling door de minister van Binnenlandse Veiligheid dat er sprake is van een binnenlandse noodsituatie, of een aanzienlijk potentieel voor een binnenlandse noodsituatie, waarbij een verhoogd risico bestaat op een aanval met een biologisch, chemisch, radiologisch of nucleair agens of agentia;
- een vaststelling door de minister van Defensie dat er sprake is van een militaire noodsituatie, of een aanzienlijk potentieel voor een militaire noodsituatie, met een verhoogd risico voor United Staten strijdkrachten, met inbegrip van personeel dat opereert onder het gezag van Titel 10 of Titel 50, van een aanval met:
- een biologisch, chemisch, radiologisch of nucleair agens of agentia; of
- een agent of agenten die een onmiddellijk levensbedreigend en specifiek risico voor United kunnen veroorzaken of daarmee in verband kunnen worden gebracht Staten strijdkrachten;
- een besluit van de Secretaris [van de gezondheidszorg en de menselijke diensten] dat er sprake is van een noodsituatie op het gebied van de volksgezondheid, of een aanzienlijk potentieel voor een noodsituatie op het gebied van de volksgezondheid, die gevolgen heeft of een aanzienlijk potentieel heeft om de nationale veiligheid of de gezondheid en veiligheid van United Staten burgers die in het buitenland wonen en waarbij sprake is van een biologisch, chemisch, radiologisch of nucleair agens of agentia, of een ziekte of aandoening die aan een dergelijk agens of agentia kan worden toegeschreven; of
- de identificatie van een materiële dreiging overeenkomstig artikel 319F–2 van de Wet openbare gezondheidszorg [42 USC 247d–6b] voldoende om de nationale veiligheid of de gezondheid en veiligheid van United Staten burgers die in het buitenland wonen.
EUA Stap 2. Voldoen aan de wettelijke criteria
Zodra een van de secretarissen heeft verklaard dat er sprake is van een noodsituatie die EUA rechtvaardigt, zijn er nog vier “wettelijke criteria” waaraan moet worden voldaan voordat de FDA de EUA kan afgeven. Hier ziet u hoe de FDA deze vereisten uitlegt:
- Ernstige of levensbedreigende ziekte of aandoening
Wil de FDA een EUA kunnen afgeven, dan moeten de CBRN-agentia waarnaar wordt verwezen in de EUA-verklaring van de HHS-secretaris in staat zijn een ernstige of levensbedreigende ziekte of aandoening te veroorzaken.
- Bewijs van effectiviteit
Medische producten die in aanmerking kunnen komen voor een EUA zijn producten die “effectief kunnen zijn” bij het voorkomen, diagnosticeren of behandelen van ernstige of levensbedreigende ziekten of aandoeningen die kunnen worden veroorzaakt door een of meer CBRN-agentia die zijn geïdentificeerd in de verklaring van de HHS-secretaris van noodsituatie of dreiging van een noodsituatie op grond van sectie 564(b).
De ‘kan effectief zijn’-standaard voor EUA’s biedt een lager bewijsniveau dan de ‘effectiviteit’-standaard die de FDA gebruikt voor productgoedkeuringen. De FDA is van plan de potentiële effectiviteit van een mogelijk EUA-product van geval tot geval te beoordelen met behulp van een risico-batenanalyse, zoals hieronder wordt uitgelegd.
[VET TOEGEVOEGD]
- Risico-batenanalyse
Een product kan in aanmerking komen voor een EUA als de commissaris vaststelt dat de bekende en potentiële voordelen van het product, wanneer het wordt gebruikt om de geïdentificeerde ziekte of aandoening te diagnosticeren, te voorkomen of te behandelen, zwaarder wegen dan de bekende en potentiële risico's van het product.
Bij het bepalen of de bekende en potentiële voordelen van het product opwegen tegen de bekende en potentiële risico's, heeft de FDA van plan is te kijken op het geheel van het wetenschappelijke bewijsmateriaal om een algehele risico-batenanalyse te maken. Dergelijk bewijs, dat zou kunnen ontstaan uit allerlei bronnen, mag inclusief (maar is niet beperkt tot): resultaten van binnenlandse en buitenlandse klinische onderzoeken, in vivo werkzaamheidsgegevens uit diermodellen en in vitro gegevens, beschikbaar voor FDA-overweging. De FDA zal ook de kwaliteit en kwantiteit van de beschikbaar bewijs, gezien de huidige stand van de wetenschappelijke kennis.
[VET TOEGEVOEGD]
- Geen alternatieven
Als de FDA een EUA wil afgeven, mag er geen adequaat, goedgekeurd en beschikbaar alternatief zijn voor het kandidaat-product voor het diagnosticeren, voorkomen of behandelen van de ziekte of aandoening. Een potentieel alternatief product kan als “niet beschikbaar” worden beschouwd als er onvoldoende voorraad is van het goedgekeurde alternatief om volledig aan de noodbehoefte te voldoen.
EUA Stap 3. Het opleggen van de vereiste voorwaarden
Zodra we de EUA-specifieke noodverklaring hebben, en zodra de FDA heeft vastgesteld dat het product effectief kan zijn en dat uit welk bewijsmateriaal dan ook blijkt dat de voordelen ervan groter zijn dan de risico's, is er nog een laag van gerelateerde regelgeving.
Hier is hoe een 2018 Congressional Research Service-rapport over EUA legt dit uit:
FFDCA §564 draagt de FDA op om bepaalde vereiste voorwaarden op te leggen in een EUA en staat waar nodig aanvullende discretionaire voorwaarden toe. De vereiste voorwaarden variëren afhankelijk van het feit of de EUA betrekking heeft op een niet-goedgekeurd product of op een niet-goedgekeurd gebruik van een goedgekeurd product. Voor een niet-goedgekeurd product moeten de gebruiksvoorwaarden:
(1) ervoor zorgen dat beroepsbeoefenaren in de gezondheidszorg die het product toedienen de vereiste informatie ontvangen;
(2) ervoor zorgen dat personen aan wie het product wordt toegediend de vereiste informatie ontvangen;
(3) zorgen voor de monitoring en rapportage van bijwerkingen die verband houden met het product; En
(4) zorgen voor het bijhouden van gegevens en rapportage door de fabrikant.
Conclusie
Zoals opgemerkt in dit artikel erkent de FDA/CDC duidelijk dat het onwaarschijnlijk is dat het proces van het verlenen van Emergency Use Authorization (EUA) enige informatie zal opleveren over de effectiviteit of veiligheid van een product. Als we kijken naar de letter van de wet die de EUA regelt, zien we dat dit inderdaad een correcte beoordeling is.
De EUA-wet legt geen wettelijke of regelgevende normen op die kunnen bepalen of een product veilig of effectief is. De enige normen zijn of de FDA gelooft dat het product effectief kan zijn en dat de bekende voordelen ervan opwegen tegen de bekende nadelen. Als er geen schadelijke of bekende voordelen bekend zijn, omdat het product nooit het goedkeuringsproces voor geneesmiddelen heeft doorlopen, kan de FDA alle informatie of standaarden gebruiken die zij verkiest om die vaststelling te doen.
Uit dit alles volgt dat een bedrijf wiens product in aanmerking komt voor EUA kan proberen de veiligheid en/of effectiviteit van het product aan te tonen met welke middelen het ook kiest. Het bestaan van een dergelijke poging (of het nu gaat om een klinische proef of een ander mechanisme voor gegevensverzameling) en hoe die poging wordt uitgevoerd, hangt allemaal af van het bedrijf. Niets in de EUA-wet is van toepassing op de manier waarop het bedrijf onderzoeken of andere mechanismen voor gegevensverzameling ontwerpt, uitvoert of analyseert die het wil volgen.
Toegepast op Covid-producten betekent dit:
- Er waren geen veiligheids- of werkzaamheidsgegevens uit klinische onderzoeken vereist om Covid-producten EUA te laten ontvangen.
- Alle klinische onderzoeken waarnaar in het EUA-proces wordt verwezen, zijn uitgevoerd zonder wettelijk toepasselijke wettelijke normen.
- Als we ontdekken dat deze producten niet werkzaam of veilig zijn, is dat geen verrassing. Het is een zeer waarschijnlijk gevolg van het proces.
- Er zijn geen gegevens uit het EUA-proces waarop niet-EUA-beslissingen over de veiligheid of werkzaamheid van het product kunnen worden gebaseerd. Voor elk niet-EUA-gebruik van het product zou dus vanaf het begin het wettelijke goedkeuringsproces voor reguliere medische producten moeten worden doorlopen.
Meer over het goedkeuringsproces voor Covid-vaccins hier.
Heruitgegeven van de auteur subgroep
Uitgegeven onder a Creative Commons Naamsvermelding 4.0 Internationale licentie
Stel voor herdrukken de canonieke link terug naar het origineel Brownstone Instituut Artikel en auteur.









