In deel één van dit artikel, heb ik het contractuele en regelgevende raamwerk beoordeeld dat door de Amerikaanse overheid werd toegepast op de initiële ontwikkeling, productie en verwerving van de Covid-mRNA-injecties, waarbij ik de BioNTech/Pfizer-overeenkomsten gebruikte om het proces te illustreren.
Ik liet zien dat er voor deze producten een Emergency Use Authorization (EUA) was verleend op basis van klinische onderzoeken en productieprocessen die waren uitgevoerd met
- geen bindende wettelijke normen,
- geen wettelijk verboden veiligheidstoezicht of -regelgeving, en
- geen juridisch verhaal van de fabrikant voor mogelijke schade.
In dit vervolgartikel zal ik een gedetailleerde analyse geven van de onderliggende documentatie.
Andere transactieautoriteit/overeenkomst (OTA): een militair acquisitietraject
De overeenkomst tussen de Amerikaanse regering, vertegenwoordigd door het Ministerie van Defensie (DoD), en Pfizer, die het BioNTech/Pfizer-partnerschap vertegenwoordigt, in juli 2020, omdat de aankoop van een “vaccin om COVID-19 te voorkomen” geen gewoon overnamecontract was.
Het was een overeenkomst onder Other Transaction Authority (OTA) – een acquisitietraject dat volgens Richtlijnen van het Ministerie van Defensie, wordt sinds 1958 gebruikt om “een federaal agentschap in staat te stellen zich aan te sluiten andere transacties dan contracten, subsidies of samenwerkingsovereenkomsten. '
[VET TOEGEVOEGD]
Een grondig overzicht van het gebruik van OTA door het DoD, inclusief de wettelijke geschiedenis ervan, is te vinden in de 22 februari 2019 rapport van de Congressional Research Service. Dit rapport specificeert, samen met elke andere discussie over OTA, dat het een alternatief acquisitietraject is voor defensie- en militaire doeleinden. Het is niet bedoeld, en is vóór Covid ook nooit gebruikt, voor iets dat in de eerste plaats bedoeld is voor civiel gebruik.
Als je zoekt OTA-wetten in de Amerikaanse Code, dit is het pad dat je gaat volgen:
Strijdkrachten -> Algemeen Militair Recht -> Verwerving -> Onderzoek en Techniek -> Overeenkomsten -> Autoriteit van het Ministerie van Defensie om bepaalde prototypeprojecten uit te voeren
Deze legale route laat heel duidelijk zien dat OTA-wetten bedoeld zijn voor de verwerving van onderzoeks- en technische prototypes voor de strijdkrachten.
Het ministerie van Defensie heeft de bevoegdheid voor drie verschillende soorten OT's: (1) onderzoeks-OT's, (2) prototype-OT's en (3) productie-OT's.
Deze drie soorten OT's vertegenwoordigen drie fasen van aanvankelijk onderzoek, ontwikkeling van een prototype en uiteindelijke productie.
Binnen deze drie typen zijn er specifieke categorieën projecten waarop OTA van toepassing kan zijn:
- Oorspronkelijk, aldus de OTA-overzicht verstrekt door het DoD, was de Other Transaction Authority “beperkt tot toepassing op wapens of wapensystemen waarvan werd voorgesteld dat ze door het DoD zouden worden verworven of ontwikkeld.”
- OTA werd later uitgebreid met “elk prototypeproject dat rechtstreeks verband houdt met het verbeteren van de missie-effectiviteit van militair personeel en de ondersteunende platforms, systemen, componenten of materialen die voorgesteld zijn om te worden verworven of ontwikkeld door het Ministerie van Defensie, of met de verbetering van platforms, systemen, componenten. , of materialen die door de strijdkrachten worden gebruikt.”
Tot nu toe klinkt niets van dit alles als een verwervingsroute voor miljoenen nieuwe medische producten die primair bedoeld zijn voor civiel gebruik.
Is er een uitzondering voor civiel gebruik van OTA die van toepassing zou kunnen zijn op Covid-mRNA-vaccins?
De FY2004 Nationale Defensiemachtigingswet (PL 108-136) bevatte een sectie waarin de Andere Transactie-autoriteit werd toegekend aan “het hoofd van een uitvoerend agentschap dat zich bezighoudt met fundamenteel onderzoek, toegepast onderzoek, geavanceerd onderzoek en ontwikkelingsprojecten” die “het potentieel hebben om de verdediging tegen of het herstel van terrorisme of nucleaire, biologische, chemische of radiologische aanval.”
Deze bepaling werd verlengd tot 2018, maar lijkt na dat jaar niet te zijn verlengd. Merk ook op dat zelfs in dit uitzonderlijke geval van OTA-gebruik buiten het DoD, er moet sprake zijn van terrorisme of een aanval met massavernietigingswapens (CBRN).
Welke andere OTA-wetten kunnen van toepassing zijn?
Het hierboven aangehaalde CRS-rapport uit 2019 biedt dit diagram, waaruit blijkt dat een paar niet-DoD-agentschappen een aantal OTA- of gerelateerde autoriteiten hebben:
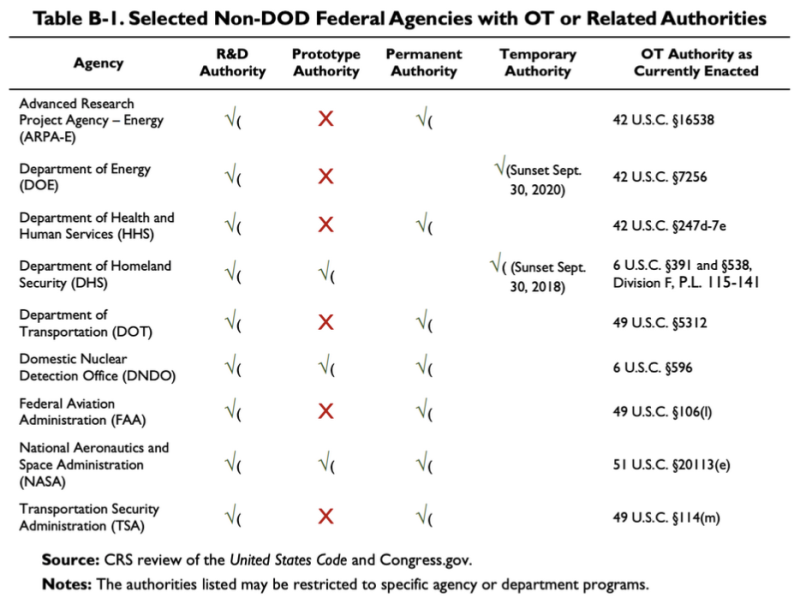
Volgens deze tabel beschikt het Department of Health and Human Services (HHS) over enkele onderzoeks- en ontwikkelingsautoriteiten (R&D) en andere transactie-autoriteiten. De wet met betrekking tot de OT-autoriteit van HHS is 42 U.S.C. §247d-7e.
Waar is deze wet ondergebracht en wat staat er in?
Volksgezondheid en Welzijn -> Volksgezondheidsdienst -> Algemene bevoegdheden en plichten -> Federale staatssamenwerking -> Biomedische Geavanceerde Onderzoeks- en Ontwikkelingsautoriteit (BARDA) -> Transactieautoriteiten
Er is dus een plaats in de wet met betrekking tot de civiele gezondheidszorg en het welzijn waar OTA van toepassing zou kunnen zijn, ook al is het geldig alleen voor onderzoek en ontwikkeling, geen prototypes of productie.
De wet bepaalt dat de BARDA-secretaris OT-autoriteit heeft
met betrekking tot een product dat een gekwalificeerde tegenmaatregel of gekwalificeerd pandemisch of epidemisch product, activiteiten die voornamelijk
i) worden uitgevoerd na fundamenteel onderzoek en de preklinische ontwikkeling van het product; En
(ii) verband houden met de vervaardiging van het product op commerciële schaal en in een vorm die voldoet aan de wettelijke vereisten van de federale overheid Wet op voedsel, medicijnen en cosmetica [21 USC 301 enz.] of onder sectie 262 van deze titel.
[VET TOEGEVOEGD]
De ‘regelgevende vereisten’ die in de wet worden opgesomd, betekenen dat het voor BARDA/HHS onmogelijk zou zijn om overeenkomsten te sluiten – zelfs alleen maar R&D – voor medische producten (zoals de mRNA-vaccins) die geen strenge veiligheidstests en strikt productietoezicht hebben ondergaan.
HHS “partnerschap” met DoD omzeilde wetten op het gebied van civiele bescherming
Om de hachelijke situatie van andere transactieautoriteiten/overeenkomsten met betrekking tot civiele autoriteiten in het algemeen en Covid-mRNA-vaccins in het bijzonder samen te vatten:
- OTA is geschreven en gecodificeerd als een manier voor het leger om wapens en andere noodzakelijke systemen en uitrusting te verwerven zonder veel bureaucratische rompslomp. Het omvat onderzoek en ontwikkeling, prototypes en daaropvolgende productie.
- De enige OTA voor een volksgezondheidsinstantie is die voor de HHS en deze heeft alleen betrekking op onderzoek en ontwikkeling, niet op prototypes of productie.
- Zelfs de R&D OTA die aan de HHS wordt gegeven, vereist nog steeds dat producten worden vervaardigd “in een vorm die voldoet aan de wettelijke vereisten” voor de veiligheid van geneesmiddelen en vaccins.
Met andere woorden: HHS had op geen enkele manier haar zeer beperkte OTA kunnen gebruiken om contracten te ondertekenen voor honderden miljoenen nieuwe medische producten.
Wat deed HHS dan?
Zoals het Government Accountability Office (GAO) in zijn rapport opmerkte Rapport van juli 2021 over “Covid-19 Contracting:” HHS “werkte samen” met DoD om “de OTA-autoriteiten van DoD te benutten… die HHS ontbeerde.” (P. 24)
Wat zijn DoD's OT-autoriteiten voor medische producten?
Zoals besproken is OTA bedoeld om het leger te helpen aan uitrusting en technologie te komen zonder veel bureaucratisch gedoe. Geen van de oorspronkelijke wetten met betrekking tot OTA vermeldde iets anders dan ‘platforms, systemen, componenten of materialen’ die bedoeld waren om ‘de effectiviteit van de missie van militair personeel te vergroten’.
Maar vijf jaar vóór Covid werd een uitzonderlijk gebruik van OTA geïntroduceerd:
In 2015, DoD aangekondigd de oprichting van het CBRN Medical Countermeasure Consortium, waarvan het doel was om het OTA-acquisitietraject te gebruiken om “met DoD samen te werken om door de FDA goedgekeurde chemische, biologische, radiologische en nucleair-medische tegenmaatregelen te ontwikkelen.” [FDA = Food & Drug Administration]
Zoals beschreven in de aankondiging van 2015 omvatte dit “prototypetechnologieën voor therapeutische medische tegenmaatregelen gericht op virale, bacteriële en biologische toxinedoelen die van belang zijn voor het Ministerie van Defensie.” De lijst met middelen omvatte de belangrijkste ziekteverwekkers voor biologische oorlogsvoering, zoals miltvuur, ebola en marburg.
De aankondiging specificeerde verder dat “enablingtechnologieën diermodellen kunnen omvatten van virale, bacteriële of biologische toxineziekten en pathogenese (meerdere blootstellingsroutes), testen, diagnostische technologieën of andere platformtechnologieën die kunnen worden toegepast op de ontwikkeling van goedgekeurde of gelicenseerde MCM’s. [medische tegenmaatregelen].”
Hoewel dit nog steeds niet klinkt als de productie van 100 miljoen nieuwe vaccins voor civiel gebruik, biedt het wel meer speelruimte voor OTA dan de zeer beperkte Other Transaction Authority die aan HHS is gegeven.
Terwijl de HHS OTA naleving van uitgebreide ontwikkelings- en productievoorschriften vereist, vereist het OTA-traject voor het DoD om medische tegenmaatregelen te ontwikkelen alleen ‘FDA-licentieverlening’.
Door gebruik te maken van DoD Other Transaction Authorities zou het dus theoretisch mogelijk zijn om veiligheidsvoorschriften te omzeilen – afhankelijk van de vereisten voor FDA-licenties voor een door OTA gegenereerd product. Zoals we zullen zien, werd in het geval van de Covid-mRNA-vaccins een Emergency Use Authorization verleend, waardoor er helemaal geen juridisch veiligheidstoezicht nodig was.
Autorisatie voor gebruik in noodgevallen (EUA)
Dit is hoe de Food & Drug Administration dat doet (FDA) beschrijft haar EUA-bevoegdheden:
Sectie 564 van de FD&C-wet (21 USC 360bbb–3) stelt de FDA in staat de bescherming van de volksgezondheid tegen biologische, chemische, nucleaire en radiologische agentia te versterken.
Met deze autoriteit van de EUA kan de FDA ervoor zorgen dat in noodsituaties medische tegenmaatregelen kunnen worden genomen om ernstige of levensbedreigende ziekten of aandoeningen veroorzaakt door biologische, chemische, nucleaire of radiologische middelen te diagnosticeren, behandelen of voorkomen, wanneer er geen adequate, goedgekeurde en beschikbare alternatieven (naast andere criteria).
Het is uiterst belangrijk om te begrijpen dat deze EUA-bevoegdheden in 2004 werden verleend onder zeer specifieke omstandigheden die verband hielden met de paraatheid voor aanvallen met massavernietigingswapens, ook wel bekend als CBRN-agentia (chemische, biologische, radiologische, nucleaire).
Zoals uitgelegd in de Bill of Health van Harvard Law,
Uiteindelijk was het de War on Terror die aanleiding zou geven tot toestemming voor gebruik in noodgevallen. Na de gebeurtenissen van 11 september 2001 en de daaropvolgende miltvuurmailaanvallen heeft het Congres de Project Bioshield-wet van 2004. De wet riep op tot miljarden dollars aan kredieten voor de aankoop van vaccins ter voorbereiding op een bioterroristische aanval, en voor het aanleggen van voorraden van noodmaatregelen. Om in geval van nood snel te kunnen handelen, stond het Congres de FDA toe formeel niet-goedgekeurde producten toe te staan voor gebruik in noodgevallen tegen een bedreiging voor de volksgezondheid en veiligheid (onder voorbehoud van een noodverklaring door HHS). De record geeft aan dat het Congres zich specifiek richtte op de dreiging van bioterreur, en niet op de voorbereiding op een natuurlijk voorkomende pandemie.
De formulering van de EUA-wet onderstreept het feit dat het bedoeld was voor gebruik in situaties waarbij massavernietigingswapens betrokken zijn. Dit zijn de 4 situaties waarin EUA kan worden afgegeven:
- een vaststelling door de minister van Binnenlandse Veiligheid dat er sprake is van een binnenlandse noodsituatie, of een aanzienlijk potentieel voor een binnenlandse noodsituatie, waarbij een verhoogd risico bestaat op een aanval met een biologisch, chemisch, radiologisch of nucleair agens of agentia;
- een vaststelling door de minister van Defensie dat er sprake is van een militaire noodsituatie, of een aanzienlijk potentieel voor een militaire noodsituatie, die een verhoogd risico voor de Verenigde Staten met zich meebrengt Staten strijdkrachten, met inbegrip van personeel dat opereert onder het gezag van Titel 10 of Titel 50, van een aanval met:
- een biologisch, chemisch, radiologisch of nucleair agens of agentia; of
- een agent of agenten die een onmiddellijk levensbedreigend en specifiek risico voor United kunnen veroorzaken of daarmee in verband kunnen worden gebracht Staten strijdkrachten;
- een besluit van de Secretaris dat er sprake is van een noodsituatie op het gebied van de volksgezondheid, of een aanzienlijk potentieel voor een noodsituatie op het gebied van de volksgezondheid, die de nationale veiligheid of de gezondheid en veiligheid van de Verenigde Staten aantast of een aanzienlijk potentieel heeft Staten burgers die in het buitenland wonen en waarbij sprake is van een biologisch, chemisch, radiologisch of nucleair agens of agentia, of een ziekte of aandoening die aan een dergelijk agens of agentia kan worden toegeschreven; of
- de identificatie van een materiële dreiging overeenkomstig artikel 319F–2 van de Wet openbare gezondheidszorg [42 USC 247d–6b] voldoende om de nationale veiligheid of de gezondheid en veiligheid van United in gevaar te brengen Staten burgers die in het buitenland wonen.
Nergens in deze vier situaties wordt er enige melding gemaakt van een natuurlijk voorkomende epidemie, pandemie of enige andere vorm van volksgezondheidssituatie die niet wordt veroorzaakt door ‘biologische, chemische, radiologische of nucleaire agentia’.
Zou SARS-CoV-2 in aanmerking kunnen komen als een dergelijk middel?
Als je zoekt naar de definitie van “biologische agentia”in de Amerikaanse juridische code bewandelt u het volgende pad:
Misdaden en strafvordering -> Misdaden -> Biologische wapens -> Definities
In de context van de Amerikaanse wetgeving betekent de term ‘biologische agentia’ dus biologische wapens, en het gebruik van dergelijke agentia/wapens wordt als een misdrijf beschouwd.
Wikipedia biedt dit aan definitie:
Een biologisch agens (ook wel bio-agent, biologisch dreigingsmiddel, biologisch oorlogsmiddel, biologisch wapen of biowapen genoemd) is een bacterie, virus, protozoa, parasiet, paddestoel, of gif dat doelbewust als wapen kan worden gebruikt bioterrorisme or biologische oorlogsvoering (ZW).
Op welke rechtsgrondslag werd EUA afgegeven voor Covid-mRNA-vaccins?
Op basis van de wetten met betrekking tot EUA lijkt het erop dat geen van de vier mogelijke situaties die in de wet worden beschreven, kan worden toegepast op een product dat bedoeld is om een ziekte te voorkomen of te behandelen die wordt veroorzaakt door een natuurlijk voorkomende ziekteverwekker.
Niettemin werd deze wet gebruikt om de mRNA-Covid-vaccins toe te staan.
Gezien de vier keuzes die in de EUA-wet worden vermeld, was degene die werd gebruikt voor de “tegenmaatregelen” van Covid dat wel
C) een vaststelling door de Secretaris dat er sprake is van een noodsituatie op het gebied van de volksgezondheid, of een aanzienlijk potentieel voor een noodsituatie op het gebied van de volksgezondheid, die de nationale veiligheid of de gezondheid en veiligheid van de Verenigde Staten aantast of een aanzienlijk potentieel heeft Staten burgers die in het buitenland wonen, en waarbij sprake is van een biologisch, chemisch, radiologisch of nucleair agens of agentia, of een ziekte of aandoening die aan een dergelijk agens of agentia kan worden toegeschreven.
. specifiek van toepassing op Covid, zo werd het verwoord:
de secretaris van het Department of Health and Human Services (HHS) heeft vastgesteld dat er sprake is van een noodsituatie op het gebied van de volksgezondheid die een aanzienlijk potentieel heeft om de nationale veiligheid of de gezondheid en veiligheid van Amerikaanse burgers die in het buitenland wonen te beïnvloeden, en waarbij het virus betrokken is dat het coronavirus veroorzaakt Ziekte 2019 (COVID-19)…
Er bestaat hier geen twijfel over dat “het virus dat COVID-19 veroorzaakt” wordt beschouwd als het equivalent van “een biologisch, chemisch, radiologisch of nucleair agens of agentia.”
Het is ook belangrijk op te merken dat de “vaststelling van een noodsituatie op het gebied van de volksgezondheid” van de EUA volledig los staat van, en op geen enkele manier afhankelijk is van, andere noodverklaringen op het gebied van de volksgezondheid, zoals die zijn afgelegd door de WHO, de Amerikaanse regering , en de president aan het begin van de Covid-19-pandemie.
Dus zelfs als de WHO, de Amerikaanse regering en de president verklaren dat de pandemie voorbij is, kan er nog steeds sprake zijn van een Emergency Use Authorization als de HHS-secretaris blijft beweren dat de situatie beschreven in sectie C) bestaat.
Als we kijken naar alle EUA’s voor honderden Covid-gerelateerde medische productenis het heel moeilijk in te zien hoe de HHS-secretaris de bewering zou kunnen rechtvaardigen dat “er sprake is van een noodsituatie op het gebied van de volksgezondheid die een aanzienlijk potentieel heeft om de nationale veiligheid of de gezondheid en veiligheid van Amerikaanse burgers die in het buitenland wonen” in de meeste, zo niet alle, aan te tasten. van deze gevallen.
Aanvullende “wettelijke criteria” voor het verlenen van toestemming voor gebruik door de FDA
Zodra de HHS-secretaris verklaart dat er sprake is van een noodsituatie op het gebied van de volksgezondheid die EUA rechtvaardigt, op basis van een van de vier in de wet genoemde situaties, zijn er nog vier “statutaire criteria” waaraan moet worden voldaan voordat de FDA de EUA kan afgeven. . Hier ziet u hoe de FDA deze vereisten uitlegt:
- Ernstige of levensbedreigende ziekte of aandoening
Wil de FDA een EUA afgeven, dan moeten de CBRN-agentia waarnaar wordt verwezen in de EUA-verklaring van de HHS-secretaris in staat zijn een ernstige of levensbedreigende ziekte of aandoening te veroorzaken.
OPMERKING: Dit criterium herhaalt de specificatie van een CBRN-agent, die wettelijk wordt gedefinieerd als een wapen dat wordt gebruikt bij het plegen van een misdrijf.
- Bewijs van effectiviteit
Medische producten die in aanmerking kunnen komen voor een EUA zijn producten die “effectief kunnen zijn” bij het voorkomen, diagnosticeren of behandelen van ernstige of levensbedreigende ziekten of aandoeningen die kunnen worden veroorzaakt door een of meer CBRN-agentia die zijn geïdentificeerd in de verklaring van de HHS-secretaris van noodsituatie of dreiging van een noodsituatie op grond van sectie 564(b).
De ‘kan effectief zijn’-standaard voor EUA’s biedt een lager bewijsniveau dan de ‘effectiviteit’-standaard die de FDA gebruikt voor productgoedkeuringen. De FDA is van plan de potentiële effectiviteit van een mogelijk EUA-product van geval tot geval te beoordelen met behulp van een risico-batenanalyse, zoals hieronder wordt uitgelegd.
[VET TOEGEVOEGD]
JURIDISCHE VRAAG: Hoe kan iemand juridisch beweren dat een product dat is goedgekeurd onder de EUA “veilig en effectief” is als de wettelijke norm voor EUA “mogelijk effectief” is en de FDA verklaart dat dit een “lager niveau van bewijs” is dan de gebruikte norm voor reguliere productgoedkeuringen?
- Risico-batenanalyse
Een product kan in aanmerking komen voor een EUA als de commissaris vaststelt dat de bekende en potentiële voordelen van het product, wanneer het wordt gebruikt om de geïdentificeerde ziekte of aandoening te diagnosticeren, te voorkomen of te behandelen, zwaarder wegen dan de bekende en potentiële risico's van het product.
Bij het bepalen of de bekende en potentiële voordelen van het product opwegen tegen de bekende en potentiële risico's, heeft de FDA van plan is te kijken op het geheel van het wetenschappelijke bewijsmateriaal om een algehele risico-batenanalyse te maken. Dergelijk bewijs, dat zou kunnen ontstaan uit allerlei bronnen, mag inclusief (maar is niet beperkt tot): resultaten van binnenlandse en buitenlandse klinische onderzoeken, in vivo werkzaamheidsgegevens uit diermodellen en in vitro gegevens, beschikbaar voor FDA-overweging. FDA zal ook de kwaliteit en kwantiteit van de beschikbaar bewijs, gezien de huidige stand van de wetenschappelijke kennis.
[VET TOEGEVOEGD]
JURIDISCHE OPMERKING: Er bestaat geen wettelijke norm en er zijn geen wettelijke definities voor wat het betekent dat ‘bekende en potentiële voordelen’ zwaarder wegen dan ‘bekende en potentiële risico’s’. Er bestaat ook geen kwalitatieve of kwantitatieve juridische definitie van wat aanvaardbaar “beschikbaar bewijs” is waarop de risico-batenanalyse “kan zijn” gebaseerd. Er kan geen feitelijk bewijs zijn, maar de overtuiging dat een product veel potentiële voordelen heeft en niet veel potentiële risico's, en dat zou aan deze ‘wettelijke vereiste’ voldoen.
- Geen alternatieven
Als de FDA een EUA wil afgeven, mag er geen adequaat, goedgekeurd en beschikbaar alternatief zijn voor het kandidaat-product voor het diagnosticeren, voorkomen of behandelen van de ziekte of aandoening. Een potentieel alternatief product kan als “niet beschikbaar” worden beschouwd als er onvoldoende voorraad is van het goedgekeurde alternatief om volledig aan de noodbehoefte te voldoen.
JURIDISCHE VRAAG: Afgezien van de flagrante en potentieel criminele belastering/verbod van alternatieve Covid-19-behandelingen zoals ivermectine en hydroxychloroquine, op welk punt was er een goedgekeurd alternatief voor het ‘voorkomen van Covid-19’ (het enige waarvoor de mRNA-vaccins werden gekocht? ) – Paxlovid bijvoorbeeld – waardoor een EUA voor de mRNA-vaccins niet langer legaal zou zijn?
Hier ziet u hoe aan al deze “wettelijke criteria” in de praktijk werd voldaan Autorisatie voor gebruik in noodgevallen voor de BioNTECH/Pfizer Covid mRNA-vaccins:
Ik ben tot de conclusie gekomen dat het gebruik in noodgevallen van het Pfizer-BioNTech COVID-19-vaccin voor de preventie van COVID-19, wanneer toegediend zoals beschreven in de Reikwijdte van de autorisatie (sectie II), voldoet aan de criteria voor de afgifte van een autorisatie op grond van sectie 564(c) van de wet, omdat:
- SARS-CoV-2 kan een ernstige of levensbedreigende ziekte of aandoening veroorzaken, waaronder ernstige luchtwegaandoeningen, bij mensen die met dit virus zijn geïnfecteerd;
- Op basis van het geheel aan wetenschappelijk bewijs waarover de FDA beschikt, is het redelijk om aan te nemen dat het Pfizer-BioNTech COVID-19-vaccin kan effectief zijn bij het voorkomen van COVID-19en dat, indien gebruikt onder de omstandigheden beschreven in deze autorisatie, de bekende en potentiële voordelen van het Pfizer-BioNTech COVID‑19-vaccin wanneer gebruikt om COVID-19 te voorkomen zwaarder wegen dan de bekende en potentiële risico's ervan; En
- Er is geen adequaat, goedgekeurd en beschikbaar alternatief voor het gebruik in noodgevallen van het Pfizer-BioNTech COVID-19-vaccin om COVID-19 te voorkomen.
[VET TOEGEVOEGD]
OPMERKING: De enige context waarin de FDA de potentiële voordelen en risico’s van het vaccin afwoog, en waarin de FDA bepaalde dat het “effectief zou kunnen zijn” was bij het voorkomen van Covid-19.
Er is geen overweging, geen bewijs van feitelijk of potentieel voordeel, en geen vaststelling dat er enige potentiële effectiviteit is voor het vaccin om iets anders te doen, waaronder: het verlagen van het risico op een ernstige ziekte, het verlagen van het risico op ziekenhuisopname, het verlagen van het risico op overlijden , waardoor het risico wordt verlaagd op aandoeningen die daadwerkelijk of mogelijk verband houden met Covid-19.
DAAROM zou men redelijkerwijs de rechtmatigheid kunnen betwijfelen van beweringen dat het vaccin “veilig en effectief” is in de context van iets anders dan “wanneer gebruikt om COVID-19 te voorkomen” – waarvan bekend was dat de vaccins NIET DOEN kort nadat ze waren geïntroduceerd. geïntroduceerd.
Als mensen te horen zou krijgen dat de mRNA-vaccins van BioNTech/Pfizer ‘veilig en effectief’ zijn in iets anders dan het voorkomen van Covid-19, en als ze zouden worden bedreigd met eventuele gevolgen als ze het vaccin niet zouden innemen voor iets anders dan het voorkomen van Covid-19, zouden ze dan misschien een legitiem argument hebben dat ze op illegale wijze zijn gedwongen een niet-goedgekeurd product te nemen onder frauduleuze claims?
Derde niveau-vereisten voor EUA voor niet-goedgekeurde producten
Zodra we de EUA-specifieke noodverklaring hebben, en zodra de FDA verklaart dat het product effectief kan zijn en dat welk bewijs dan ook beschikbaar is (van nul tot oneindig) aantoont dat de voordelen ervan groter zijn dan de risico’s (zoals bepaald door wat de FDA denkt dat die zouden kunnen zijn). be), is er nog een laag van niet-veiligheids- en niet-werkzaamheidsgerelateerde regelgeving.
Hier is hoe een 2018 Congressional Research Service-rapport over EUA legt dit uit:
FFDCA §564 draagt de FDA op om bepaalde vereiste voorwaarden op te leggen in een EUA en staat waar nodig aanvullende discretionaire voorwaarden toe. De vereiste voorwaarden variëren afhankelijk van het feit of de EUA betrekking heeft op een niet-goedgekeurd product of op een niet-goedgekeurd gebruik van een goedgekeurd product. Voor een niet-goedgekeurd product moeten de gebruiksvoorwaarden:
(1) ervoor zorgen dat beroepsbeoefenaren in de gezondheidszorg die het product toedienen de vereiste informatie ontvangen;
(2) ervoor zorgen dat personen aan wie het product wordt toegediend de vereiste informatie ontvangen;
(3) zorgen voor de monitoring en rapportage van bijwerkingen die verband houden met het product; En
(4) zorgen voor het bijhouden van gegevens en rapportage door de fabrikant.
JURIDISCHE VRAAG: Wat is precies de “vereiste informatie?” We weten dat mensen werden geïnformeerd dat de vaccins een Emergency Use Authorization kregen. Maar werd hen verteld dat dit “een lager bewijsniveau” betekent dan vereist is voor “veilige en effectieve” claims op andere medische producten? Werd hen verteld dat er verschillende niveaus van ‘veilig en effectief’ zijn, afhankelijk van of een product EUA of een ander type autorisatie heeft?
OPMERKING: De wet vereist dat er een manier is om bijwerkingen te monitoren en te rapporteren. Er staat echter niet in wie controleert, wat de normen zijn voor rapportage en wat de drempel is om actie te ondernemen op basis van de meldingen.
EUA vergeleken met elk ander goedkeuringstraject voor geneesmiddelen/vaccins
Als onderzoeker/schrijver Sasha Latypova heeft opgemerkt dat veel mensen in de war raakten door EUA, omdat het veel op EAU lijkt, wat staat voor ‘Expanded Access Use’. Dit is een soort autorisatie die wordt gegeven aan medische producten wanneer er een dringende behoefte is aan een bepaalde groep patiënten (bijvoorbeeld stadium IV-kankerpatiënten van wie de levensverwachting wordt gemeten in maanden) die bereid zijn het risico te lopen op bijwerkingen en zelfs de dood in ruil voor toegang tot een experimentele behandeling.
Autorisatie voor gebruik in noodgevallen houdt op geen enkele wijze verband met, en vertoont ook geen enkele gelijkenis met gebruik met uitgebreide toegang.
De verschillende legale trajecten voor het autoriseren van medische producten worden netjes weergegeven in een tabel, uitgelicht door juridisch onderzoeker Katherine Watt. De tabel maakt deel uit van een presentatie uit 2020 voor een gezamenlijke leersessie van de FDA en de CDC: Regelgevingsupdates over het gebruik van medische tegenmaatregelen.
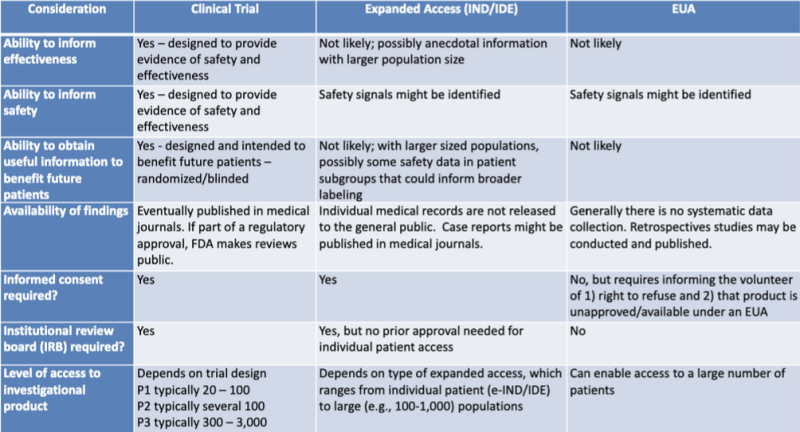
Uit deze tabel blijkt heel duidelijk dat het onwaarschijnlijk is dat het EUA-proces informatie zal opleveren over de effectiviteit van het product, niet is ontworpen om bewijs van de veiligheid te leveren, waarschijnlijk geen bruikbare informatie zal opleveren ten behoeve van toekomstige patiënten, geen systematische gegevensverzameling inhoudt, geen retrospectieve onderzoeken vereist, geen geïnformeerde toestemming en geen institutionele beoordelingsraad.
Bovendien, in een 2009 Institute of Medicine van de National Academic publicatie, ook benadrukt door Watt, getiteld “Medical Countermeasures: Dispensing Emergency Use Authorization and the Postal Model – Workshop Summary” vinden we deze verklaring op p. 28:
Het is belangrijk om te erkennen dat een EUA geen deel uitmaakt van het ontwikkelingstraject; het is een volledig afzonderlijke entiteit die alleen tijdens noodsituaties wordt gebruikt en geen deel uitmaakt van het goedkeuringsproces voor geneesmiddelen.
Betekent dit dat goedkeuringen van Covid-19-tegenmaatregelen die waren gebaseerd op EUA’s illegaal waren? Betekent dit dat er geen legale manier is om te beweren dat een EUA-product “veilig en effectief” is, omdat het GEEN DEEL IS VAN HET PROCES VOOR DE GOEDKEURING VAN DRUGS?
Conclusie
Het is overduidelijk, gezien alle informatie in dit artikel en in het voorgaande Deel 1, dat de BioNTach/Pfizer Covid-mRNA-vaccins zijn ontwikkeld, vervaardigd en geautoriseerd onder militaire wetten die gereserveerd zijn voor noodsituaties waarbij sprake is van biologische oorlogsvoering/terrorisme, en niet voor natuurlijk voorkomende ziekten die de gehele burgerbevolking treffen.
Daarom was de naleving van de regelgeving en het toezicht dat we verwachten aan te treffen wanneer een product als ‘veilig en effectief’ wordt beschouwd voor de gehele burgerbevolking, niet wettelijk vereist.
Kan deze analyse worden gebruikt om de wettigheid van de ‘veilige en effectieve’ claim van die overheidsfunctionarissen die wisten wat EUA inhield, aan te vechten? Zijn er nog andere juridische gevolgen?
Ik hoop het.
Belangrijk is dat er bij de tot nu toe ingediende juridische uitdagingen tegen Covid-mRNA-vaccins (voor zover ik weet) geen uitspraken zijn gedaan over de vraag of het militaire recht, zoals OTA en EUA, kan worden toegepast op civiele situaties. Er is echter een verklaring van districtsrechtbank Michael Truncale in zijn afwijzing van de zaak klokkenluider Brook Jackson tegen Ventavia en Pfizer, dat is belangrijk om in gedachten te houden.
Hier erkent de rechter dat de overeenkomst voor de mRNA-vaccins van BioNTech/Pfizer een militaire OTA was, maar hij weigert uitspraak te doen over de toepasselijkheid ervan op de niet-militaire omstandigheden (natuurlijk voorkomende ziekten, 100 miljoen doses, meestal niet voor militair gebruik) waaronder de overeenkomst werd uitgegeven:
Het feit dat zowel militairen als burgers het vaccin kregen, wijst er niet op dat het verkrijgen van het vaccin niet relevant was voor het vergroten van de effectiviteit van de missie van het leger. Belangrijker nog is dat mevrouw Jackson dit Hof in feite vraagt om het besluit van het DoD om de Other Transaction Authority uit te oefenen om het vaccin van Pfizer te kopen, te herroepen. Maar zoals het Hooggerechtshof van de Verenigde Staten al lang benadrukt, zijn de “complexe, subtiele en professionele beslissingen met betrekking tot de samenstelling, training, uitrusting en controle van een militaire macht in wezen professionele militaire oordelen.” Gilligan tegen Morgan, 413 VS 1, 10 (1973). Het is dus “moeilijk om een terrein van overheidsactiviteit voor te stellen waarop de rechtbanken minder bevoegd zijn.” ID kaart. Dit Hof zal geen veto uitspreken over de uitspraken van het DoD over de effectiviteit van missies tijdens een nationale noodsituatie.
Dit is slechts een van de vele juridische hindernissen die er nog zijn in de strijd om uiteindelijk alle mRNA-producten die tijdens de Covid-19-noodtoestand zijn goedgekeurd, en alle daaropvolgende mRNA-producten waarvan de goedkeuring was gebaseerd op het Covid-19-goedkeuringsproces, uiteindelijk te verbieden.
Uitgegeven onder a Creative Commons Naamsvermelding 4.0 Internationale licentie
Stel voor herdrukken de canonieke link terug naar het origineel Brownstone Instituut Artikel en auteur.









