Deze week heeft de Amerikaanse Food and Drug Administration (FDA) geautoriseerd het gebruik van een enkele booster van het covid-19-vaccin van Pfizer bij kinderen van 5-11 jaar, ten minste vijf maanden na voltooiing van een primaire reeks vaccinaties. De adviescommissie van de CDC zal naar verwachting vandaag het besluit goedkeuren.
Volgens de FDA was het bewijs dat ten grondslag lag aan zijn beslissing afkomstig van een subset van 67 kinderen die deel uitmaakten van een lopende proef en 7-9 maanden na hun primaire serie een boost kregen. Ze vertoonden een maand na de booster hogere antilichaamniveaus in vergelijking met vóór de booster.
De beslissing van de FDA is om verschillende redenen gedurfd.
Tekort aan data
Net wanneer de FDA betere gegevens zou moeten eisen, verlaagt het bureau zijn normen.
Geen enkele rigoureuze studie in deze leeftijdsgroep heeft aangetoond dat een derde dosis belangrijke uitkomsten zoals ziekenhuisopnames en sterfgevallen kan verminderen - de gerandomiseerde klinische onderzoeken zijn niet gedaan, ondanks het feit dat Pfizer miljarden aan inkomsten verdient.
In plaats daarvan was de beslissing gebaseerd op de aanwezigheid van "neutraliserende antilichamen" omdat ze gemakkelijk te meten en te bestuderen zijn. Niet alleen vervagen antilichaamniveaus snel, maar ze correleren ook niet noodzakelijk met bescherming.
Die van de FDA van de zegt dat “antilichaamtests niet mogen worden gebruikt om het niveau van immuniteit of bescherming van een persoon tegen covid-19 te evalueren.” En toch is dit wat het bureau heeft gedaan.
Dit volgt op vorige gegevens uit New York tijdens de ommicrongolf die de effectiviteit van het vaccin van Pfizer bij 5-11-jarigen aantoonde, kelderde van 68% medio december 2021, tot slechts 12% in januari 2022, ruim onder de oorspronkelijke drempel van 50% van de FDA.
De kortzichtige focus op antilichamen door regelgevers van geneesmiddelen en gezondheidsautoriteiten ging ten koste van het overwegen van andere belangrijke aspecten van het immuunsysteem, zoals CD4+ T-cellen en natuurlijke killerreacties, die een cruciale rol spelen bij het voorkomen van infectie en waarvan wordt aangenomen dat ze duurzamer dan antistoffen. Helaas zijn deze gegevens grotendeels genegeerd door de autoriteiten.
Dr. Peter Marks, directeur van het Center for Biologics Evaluation and Research van de FDA, erkende dat: gegevens tonen steeds meer die bescherming na twee doses na verloop van tijd afneemt, en dat een derde injectie zou kunnen helpen de bescherming voor kinderen in de leeftijdsgroep van 5 tot 11 jaar te verbeteren, omdat de "voordelen opwegen tegen de risico's".
In termen van veiligheid heeft de FDA echter slechts ongeveer 400 kinderen beoordeeld die een boosterdosis kregen en ernstige, zeldzame schade zou niet worden gedetecteerd in zo'n kleine steekproefomvang.
Natuurlijke immuniteit negeren
Door een derde dosis toe te staan voor alle 5-11-jarigen - van wie de meesten al een natuurlijke immuniteit hebben - is het onwaarschijnlijk dat dit verder voordeel oplevert en hen blootstelt aan onnodige schade.
De Amerikaanse CDC gerapporteerd dat ongeveer 75% van de kinderen en adolescenten serologisch bewijs (antilichamen) van een eerdere infectie hebben en daarom al een robuuste en duurzame bescherming tegen covid-19 hebben ontwikkeld.
De Britse regering geschat dat meer dan 85% van de kinderen in de leeftijd van 5-11 jaar covid-19 had opgelopen in januari 2022 en dat hun verworven natuurlijke immuniteit bescherming zou bieden tegen ernstige ziekten of toekomstige herinfectie.
Marty Makary, professor aan de Johns Hopkins School of Medicine schreef in The Wall Street Journal dat de natuurlijke immuniteit waarschijnlijk zeer robuust is bij kinderen gezien hun sterkere immuunsysteem. Hij zei dat als een kind al covid-19 had gehad, “er geen wetenschappelijke basis zou zijn voor vaccinatie.”
Hij merkte ook op dat er geen gevallen van covid-19 werden gedocumenteerd in de gevaccineerde groep of de placebogroep bij kinderen die eerder waren geïnfecteerd met SARS-CoV-2 tijdens de proef van Pfizer, wat het voordeel van natuurlijke immuniteit versterkte.
Adviescommissie
De Vaccines and Related Biological Products Advisory Committee (VRBPAC) biedt niet alleen inzicht en expertise aan het bureau, maar het verleent ook geloofwaardigheid en betrouwbaarheid aan het FDA-besluitvormingsproces.
De FDA heeft deze week echter haar adviespanel niet bijeengeroepen en zei dat het al tijdens een eerdere vergadering boosters had besproken en dat verdere discussie geen zin zou hebben.
Sommige leden hebben hun bezorgdheid geuit over het feit dat de regelgevende instantie voor geneesmiddelen herhaaldelijk is doorgegaan met beslissingen over boosterdoses zonder openbare discussies te houden, en zeggen dat het bureau steeds minder afhankelijk is van zijn onafhankelijke experts voor advies alvorens medicijnen goed te keuren.
In een recente analyse, toonden onderzoekers aan dat slechts 6% van de door de FDA goedgekeurde geneesmiddelen in 2021 door adviespanels werd beoordeeld, tegen 55% in 2010 (zie afbeelding).
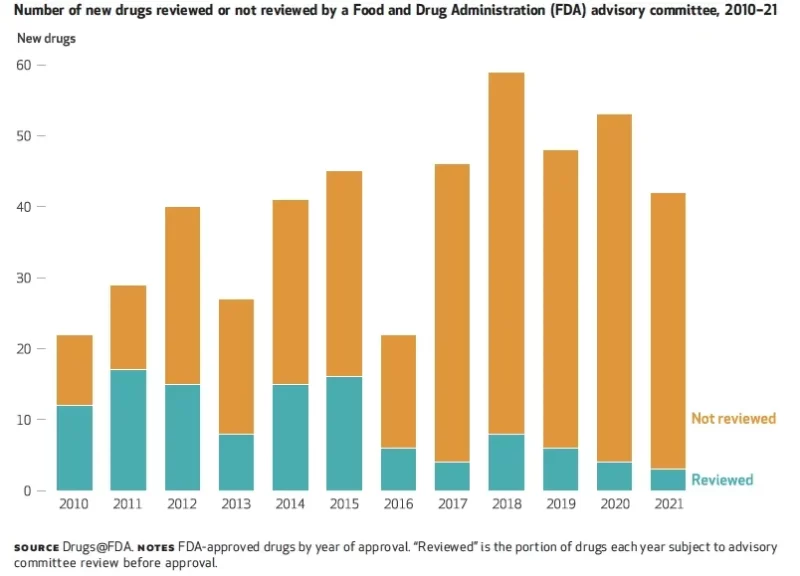
Als het vertrouwen van het publiek deze cijfers weerspiegelt, hebben regelgevende instanties nog een lange weg te gaan om het vertrouwen in hun besluitvormingsprocessen terug te winnen.
Opname?
Ondanks de voortdurende uitbreiding van boosters, lijkt het enthousiasme voor de vaccins af te nemen. De covid-19-vaccins zijn niet zo effectief in het voorkomen van infectie en overdracht als oorspronkelijk werd gehoopt, en met zo'n klein risico op ernstige ziekten bij kinderen raken ouders minder overtuigd.
A recente Amerikaanse enquête ontdekte dat bijna een derde van de ouders van kinderen jonger dan 5 jaar zei dat ze hun kind in de eerste plaats "absoluut niet" zouden laten vaccineren, nog eens 11% zei dat ze dit alleen zouden doen als dat nodig is (mandaat), en 38% was van plan om te wachten om te zien hoe het vaccin voor anderen werkte.
Pfizer moet zijn aanvraag nog indienen bij de FDA voor een vaccin met drie doses voor kinderen onder de 5 jaar, maar dit zal naar verwachting in de komende weken gebeuren.
Oorspronkelijk gepost op de auteur website
Uitgegeven onder a Creative Commons Naamsvermelding 4.0 Internationale licentie
Stel voor herdrukken de canonieke link terug naar het origineel Brownstone Instituut Artikel en auteur.









