The Telegraph meldde onlangs dat het publiek is verteld om te stoppen met het gebruik van medicijnen tegen hoest en verkoudheid vanwege veiligheidsangsten met betrekking tot het medicijn, folcodine, een opioïde hoestonderdrukker.
Twintig van de gebruikelijke medicijnen tegen hoest en verkoudheid, waaronder Day and Night Nurse-capsules, zijn op bevel van de geneesmiddelenregulatoren met spoed uit de handel genomen vanwege bezorgdheid over een "zeer zeldzaam" risico op anafylaxie, een levensbedreigende bijwerking.
De 'Class 2 Medicines Recall'-aankondiging overgenomen van de Britse regering van de, wordt hieronder weergegeven.

Als het gaat om de mRNA COVID-19-vaccins, zijn de dubbele standaarden in de regelgeving nog nooit zo overduidelijk geweest.
Anafylaxie werd al in december 2020 door het Europees Geneesmiddelenbureau geïdentificeerd als een belangrijk risico in het CHMP (Committee for Medicinal Products for Human Use) van het EMA. beoordelingsverslag over het Pfizer-BioNTech COVID-19-vaccin, hieronder te zien.
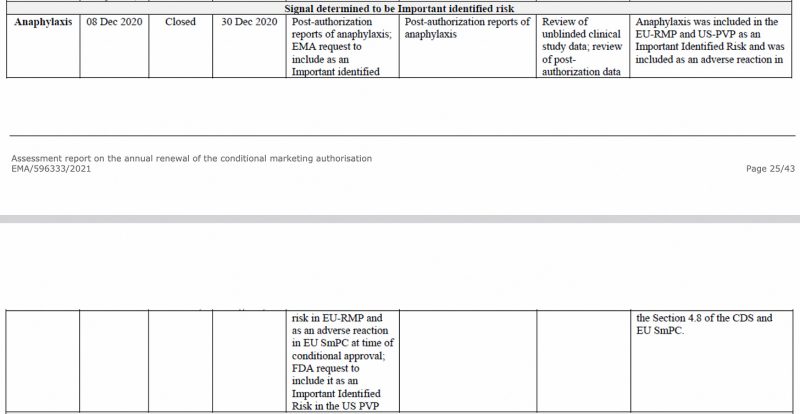
Ook in de eerste periodieke veiligheidsupdate van de EU Rapport, die ik eerder heb gehad geanalyseerd, werd anafylaxie opnieuw gemarkeerd als een belangrijk geïdentificeerd risico.

In dit geneesmiddelenbewakingsrapport werden 3,827 relevante gevallen (individuen) geïdentificeerd, uit de post-autorisatiegegevens. Het land met de hoogste incidentie was Japan, gevolgd door de VS en het VK.
Het hoogste aantal gemelde gevallen was bij vrouwen, een schokkende 3,182 gevallen vergeleken met 454 gevallen voor mannen, met een mediane leeftijd van 44. Het feit dat er 7 keer meer gevallen werden gemeld voor vrouwen is niets nieuws. In december 2021 heb ik geanalyseerd de Pfizer voorbereid document voor de FDA, voor de periode van 3 maanden, december 2020 tot en met 28 februari 2021 – in het geval van anafylaxie werden vrouwen 8 keer meer getroffen.
Dus 98 procent van de relevante bijwerkingen (waaronder anafylactische reactie, anafylactische shock, anafylactoïde reactie en anafylactoïde shock) werd geclassificeerd als ernstig!
Bovendien was voor 92 procent van de gebeurtenissen de tijd die verstreek voordat een bijwerking optrad na toediening van het vaccin, minder dan 24 uur.

Fatale gevolgen
Van de 3,922 gebeurtenissen waren er 28 fataal en van maar liefst 704 was de uitkomst onbekend. Er werden geen zaaknummers gegeven voor fatale afloop.

Gevallen per leeftijdsgroep
Van de 3,827 relevante gevallen (individueel) waren er 23 afkomstig uit de pediatrische leeftijdsgroep en 3,021 uit de volwassen leeftijdsgroep.
Aanwezigheid van comorbiditeiten
Wat opmerkelijk is, is dat ongeveer 2/3 van alle gevallen van anafylaxie dat deed niet comorbiditeiten (onderliggende gezondheidsproblemen) hebben.

Gezien wat er is gebeurd sinds de mRNA COVID-19-vaccins zijn uitgerold, is het geen verrassing om te lezen: “geen nieuwe veiligheidsinformatie werd geïdentificeerd met betrekking tot het risico op anafylaxie met BNT162b2” (Pfizer-BioNTech COVID-19-vaccin). De reden die wordt gegeven (of het excuus waarachter ze zich verschuilen) is dat 'dit risico wordt gecommuniceerd... met inbegrip van informatie over de te nemen maatregelen, als volgt: in geval van een zeldzaam anafylactisch voorval na toediening van het vaccin.”
Onder Voorschrift 174, Informatie voor zorgprofessionals in het VK, die voor het laatst is herzien in december 2021, wordt het volgende vermeld:

n feite, op de zeer eerste dag van de uitrol van het Pfizer-BioNTech COVID-19-vaccin in het VK waren er twee meldingen van anafylaxie en één melding van een mogelijke allergische reactie. Dit weerhield de MHRA er niet van om het product terug te roepen - ze omzeilden de kwestie eenvoudig door te stellen dat mensen met een voorgeschiedenis van allergieën het vaccin niet mogen gebruiken.
Zelfs toen ze het wisten - Pfizer/BioNTech's lipide-nanodeeltjes-ingrediënten ALC-0159 en ALC-0315 zijn nog nooit eerder in een goedgekeurd medicijn opgenomen. ALC-0159 bevat PEG (polyethyleenglycol). waarvan bekend is dat ze anafylaxie veroorzaken.
Het is ondubbelzinnig: anafylaxie was een bekende levensbedreigende bijwerking, rond dezelfde tijd dat toestemming voor gebruik in noodgevallen werd verleend voor het Pfizer-BioNTech COVID-19-vaccin. Maar omdat het een "injecteerbaar vaccin" is, heeft het op de een of andere manier een vrije doorgang gekregen van alle geneesmiddelenregulatoren, ongeacht hoeveel vernietigende gegevens zich verzamelen, wanneer een hoestsiroop of capsule aan de andere kant dringend wordt teruggeroepen op basis van een "een zeer zeldzaam risico op anafylaxie.”
Heruitgegeven van de auteur subgroep
Uitgegeven onder a Creative Commons Naamsvermelding 4.0 Internationale licentie
Stel voor herdrukken de canonieke link terug naar het origineel Brownstone Instituut Artikel en auteur.









